FDA exige alerta sobre riscos cardíacos em vacinas de COVID-19 para jovens

Um alerta importante feito recentemente por um cardiologista durante uma audiência no Congresso americano parece ter sido coletado pela Food and Drug Administration (FDA), órgão responsável pela aprovação e fiscalização de medicamentos e alimentos nos Estados Unidos, equivalente à Anvisa no Brasil. Após registros e estudos que documentaram casos de mortes súbitas por infarto fulminante em jovens, possivelmente relacionados à vacinação contra a COVID-19, a agência sanitária americana determinou que as farmacêuticas Pfizer e Moderna atualizem as bulas de suas vacinas com informações sobre os riscos possíveis de efeitos adversos cardíacos. A nova rotulagem obrigatória passa a informar que os maiores riscos de miocardite (inflamação do músculo cardíaco) e pericardite (inflamação do revestimento do coração) são observados principalmente em homens entre 16 e 25 anos, com casos documentados representando cerca de 38 em um milhão nessa faixa etária, segundo estudos recentes do próprio FDA. Isso representa mais do que o triplo do risco estimado para outras faixas etárias. Vinay Prasad, novo diretor médico do Centro de Avaliação e Pesquisa da FDA, destacou que estudos baseados em exames de ressonância magnética cardíaca apontam para a persistência de sinais de dano no miocárdio meses após a manifestação da miocardite, o que pode indicar um prognóstico reservado e não benigno para alguns pacientes. Cerca de 92% dos casos com esses sinais são em homens, conforme dados monitorados. A FDA reforçou, porém, que esses casos são raros e que a maioria dos pacientes apresenta melhora, mas ressalta a necessidade de transparência e informação clara para médicos e pacientes sobre esses riscos. A atualização nas bulas das vacinas Comirnaty (Pfizer) e Spikevax (Moderna) é uma medida para garantir essa ampliação da segurança e do conhecimento público. Além disso, a agência avisa que pesquisas para avaliar possíveis efeitos cardíacos de longo prazo continuam em andamento. A vacinação permanece uma ferramenta fundamental no controle da pandemia, mas com monitoramento rigoroso e configurações conforme novas evidências surgem. No Brasil, a Anvisa também acompanha os dados e mantém a recomendação do uso das vacinas como seguras e eficazes, ressaltando que as manifestações cardíacas pós-vacinação são extremamente raras e investigadas com cuidado para confirmar possíveis relações causais. Este artigo é um resumo das atualizações oficiais da FDA sobre o tema, com base em estudos científicos, declarações da agência e informações públicas recentes. A atualização do alerta cardíaco visa maior conhecimento e cuidado especial com os grupos de risco demarcados.
Anvisa proíbe venda de 32 suplementos de empresa de produtos naturais

A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a apreensão e proibiu a comercialização, a fabricação, a importação e a propaganda de 32 suplementos alimentares da empresa Ervas Brasillis Produtos Naturais Ltda. A medida, publicada no Diário Oficial da União, foi adotada após inspeção revelar que os itens eram produzidos em estabelecimento sem licença sanitária, em condições insalubres de higiene e sem atender às boas práticas de fabricação de alimentos. Saiba quais produtos tiveram a venda proibida. Creatina Monohidratada Sabor Frutas Vermelhas Marca Turbo Black Vitamin (todos). Creatina Marca Turbo Black Vitamin (todos). Colágeno Tipo II Não Desnaturado Sabor Iogurte Marca Turbo Black (todos). Colágeno Hidrolisado Sabor Frutas Tropicais Marca Turbo Black Vitamin (todos). Cafeína com Taurina Marca Turbo Black Vitamin (todos). Moringa Marca Ervas Brasil (todos). Maca Peruana Marca Ervas Brasil (todos). Hibisco Marca Ervas Brasil (todos). Graviola Marca Ervas Brasil (todos). Tadala Natural Marca NB Nutrition (todos). Magnésio Treonato Marca Turbo Black Vitamin (todos). Maca Peruana Marca Turbo Black Vitamin (todos). Maca Preta Marca Turbo Black Vitamin (todos). Lactoze sem Glúten Marca Turbo Black Vitamin (todos). L-Arginina e Alanica Marca Turbo Black Vitamin (todos). K2 + D3 2000 Ui Turbo Marca Black Vitamin (todos). Energy Maca Marca Turbo Black Vitamin (todos). Creatina Monohidratada Sabor Laranja Marca Turbo Black Vitamin (todos). Ômega 3 Marca NB Nutrition (todos). Moringa Oleifera Marca NB Nutrition (todos). Magnésio Treonato Marca NB Nutrition (todos). Magnésio Dimalato Marca NB Nutrition (todos). Colágeno Tipo II Não Desnaturado Marca NB Nutrition (todos). Cabelo Pele e Unha Marca NB Nutrition (todos). Lactoze Marca Natuforme Produtos Naturais (todos). Óleo de Girassol Ozonizado Marca Ozonlife (todos). Maca Premium Marca Nutrição Esportiva (todos). Max Vision Marca Turbo Black Vitamin (todos). Ácido Hialurônico + Colágeno Tipo II Marca NB Nutrition (todos). Maca Peruana Concentrado Marca Max Force (todos). Ora Pró Nobis Premium Marca Vitacorpus (todos). Todos os Produtos Fabricados por Ervas Brasillis (todos). A Agência Brasil não conseguiu contato com a empresa. O espaço está aberto para posicionamento, Fonte
Anvisa manda apreender lotes falsos de Mounjaro e remédio para câncer
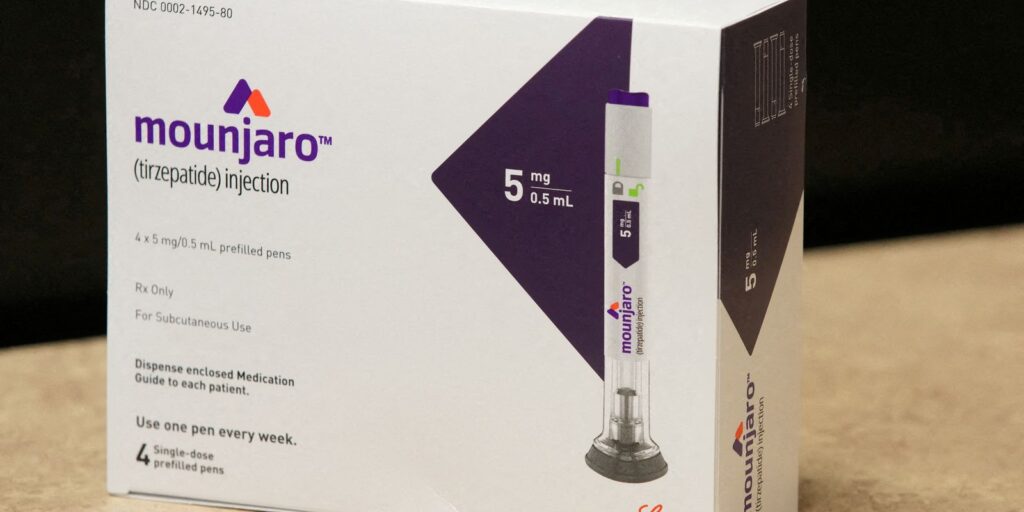
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou, nesta quinta-feira (4), a apreensão de um lote falsificado do medicamento Mounjaro e um outro lote de Opdivo, remédio usado no tratamento de câncer. De acordo com a agência reguladora, está proibida a venda, distribuição e uso do lote 082024 do Mounjaro. Este lote foi produzido por uma empresa desconhecida após a Eli Lilly, fabricante do medicamento, ter comunicado a Anvisa que não produziu o lote citado. O lote ACS1603 da marca Opdivo também foi fabricado por empresa desconhecida, por isso foi apreendido e a comercialização, distribuição e uso estão proibidos. A Anvisa foi informada do caso pela Bristol-Myers Squibb, fabricante do remédio. A Anvisa informa que, por serem produtos falsificados, “não há nenhuma garantia sobre o seu conteúdo, origem ou qualidade”. “Por isso, não devem ser usados em nenhuma hipótese”, alerta. Quem identificar os lotes falsos pode informar a Anvisa pelos canais de atendimento. Fonte
Anvisa proíbe anel que permite medir glicose sem picada de agulha

A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu o uso de alguns medidores de glicose sem o uso de agulha. Os produtos prometem, sem nenhuma base científica, medir os níveis de glicose, de oxigênio e atividade cardíaca por meio de um anel, sem precisar furar o dedo para retirar o sangue. A medida proíbe a comercialização, distribuição, fabricação, importação, manipulação, propaganda e o uso dos seguintes produtos: Anel para Acupressão Glucomax; Glicomax, Glucomax e Glucomax Pro. De acordo com a Anvisa, nenhum dos produtos tem eficácia comprovada e nem registro sanitário na agência. Eles estão sendo anunciados e colocados à venda em diversos sites de compras online e nas redes sociais como Instagram, Facebook e Tik Tok. Além disso, os anúncios utilizam imagens de pessoas famosas para enganar os consumidores. Orientações Produtos sem registro ou regularização não oferecem garantia de qualidade, segurança e eficácia, representando sérios riscos à saúde e por isso não devem ser utilizados. Denúncias sobre produtos irregulares devem ser feitas à Anvisa, por meio da Ouvidoria ou pela Central de Atendimento (0800 642 9782). Fonte
Anvisa proíbe versões manipuladas da semaglutida, usada no Ozempic
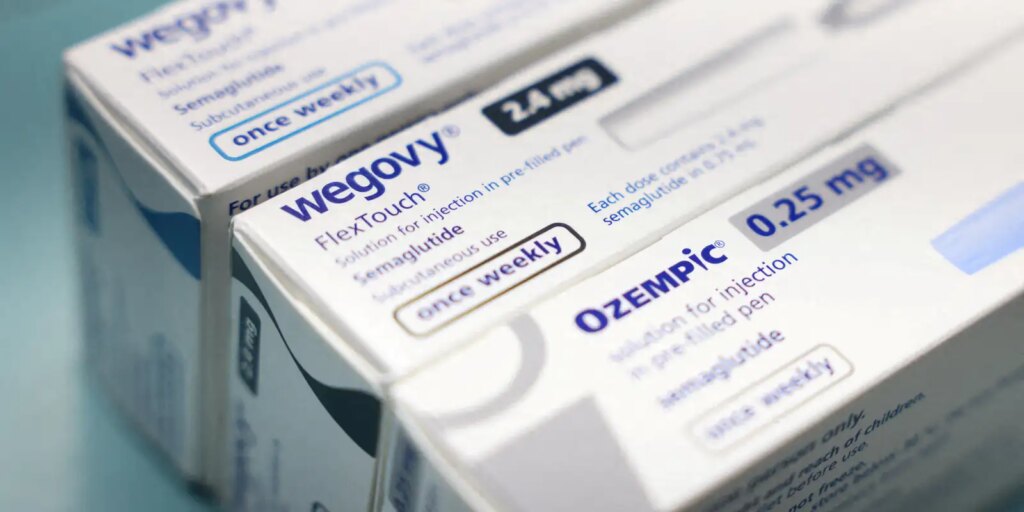
A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a manipulação da substância semaglutida, utilizada em canetas de emagrecimento como Ozempic e Wegovy e no medicamento via oral Rybelsus. Em despacho publicado na última segunda-feira (25) no Diário Oficial da União, a agência estabeleceu os critérios para importação e manipulação de insumos farmacêuticos ativos (IFAs) agonistas do hormônio GLP-1, usado em tratamentos de diabetes tipo 2 e obesidade. Segundo a decisão, os insumos obtidos por via biotecnológica, caso da semaglutida, só podem ser importados para fins de manipulação se forem do mesmo fabricante registrado no Brasil. “Atualmente, a semaglutida possui registro apenas como produto biotecnológico. Portanto, não é permitida a importação nem a manipulação da semaglutida sintética até que exista um medicamento registrado com o IFA sintético”, explicou a agência. A Sociedade Brasileira de Endocrinologia e Metabologia (SBEM) considerou a proibição da manipulação da semaglutida um passo fundamental para a proteção da população brasileira “contra práticas que colocam em risco sua saúde e minam a confiança na medicina baseada em evidências” A Novo Nordisk, detentora da patente da semaglutida e fabricante do Ozempic, do Wegovy e do Rybelsus, considera a decisão da Anvisa um benefício para a saúde pública e para os pacientes brasileiros. “Medicamentos irregulares não oferecem garantia de pureza, dosagem correta, estabilidade ou esterilidade, podendo resultar em ineficácia do tratamento, reações adversas graves e contaminação, colocando a saúde e segurança do paciente em risco”, diz a empresa, em nota. >> Siga o canal da Agência Brasil no WhatsApp Mounjaro Na decisão, a Anvisa manteve a permissão para a manipulação da tirzepatida, outra substância utilizada no tratamento da obesidade e do diabetes tipo 2, conhecida comercialmente como Mounjaro. Para a Sociedade Brasileira de Endocrinologia e Metabologia, os riscos que levaram à proibição da semaglutida são “idênticos e igualmente graves” no caso da tirzepatida manipulada. “A manutenção de uma proibição parcial, restrita apenas à semaglutida, abre espaço para a migração do mercado irregular para a tirzepatida manipulada, perpetuando o risco sanitário e expondo pacientes a produtos inseguros”, diz a entidade. A SBEM solicitou formalmente que a Anvisa estenda a medida cautelar também à tirzepatida, proibindo sua manipulação em território nacional. Fonte
Como o Butantan se tornou o maior produtor da vacina Influenza no Brasil e se prepara para pandemias

Desde 2013, mais de 560 milhões de doses de vacina da gripe já foram produzidas; Butantan ajudou no combate da H1N1 em 2010 e desenvolve vacina contra a gripe aviária Em produção pelo Instituto Butantan desde 2013, após transferência de tecnologia da farmacêutica francesa Sanofi, a vacina Influenza se tornou o carro-chefe e o maior objeto de estudo da instituição. Hoje, 90 milhões de doses são produzidas anualmente para atender à Campanha Nacional de Vacinação contra a Gripe. Para além da versão trivalente sazonal, o Butantan se dedica a estudar vacinas quadrivalentes, contra cepas pandêmicas da influenza e vacinas com adjuvantes, visando preparar o país para epidemias de gripe e desenvolver produtos cada vez mais eficientes. LEIA TAMBÉM: Maior estudo clínico do Butantan, vacina da dengue ajuda a estruturar resposta rápida a epidemias Tudo isso exige uma infraestrutura adequada para a realização de ensaios clínicos, etapa em que a segurança e eficácia dos produtos são avaliados em seres humanos. Este trabalho fica a cargo da Divisão de Ensaios Clínicos e Farmacovigilância do Butantan: dos mais de 30 estudos clínicos já coordenados pela área, 10 eram relacionados à influenza. A experiência do Butantan com a vacina da gripe data de 1999, quando foi assinado o acordo de transferência tecnológica com a Sanofi, encabeçado pelo então diretor Isaias Raw. De alta complexidade, o processo foi feito por etapas e levou mais de 10 anos para ser concluído. O Butantan começou recebendo o imunizante pronto da Sanofi para inspecionar, fazer o controle de qualidade, rotular, embalar e entregar ao Ministério da Saúde. Com o passar dos anos, a instituição foi assumindo o envase, depois a formulação da vacina e, por fim, a produção dos três monovalentes em fábrica própria. “Nos primeiros anos, o local de produção registrado era a fábrica da Sanofi, na França. Após a conclusão da transferência de tecnologia, a fábrica do Butantan recebeu a certificação da Anvisa [Agência Nacional de Vigilância Sanitária] para começar a operar e produzir a vacina Influenza do começo ao fim”, afirma o gerente de Desenvolvimento e Inovação de Produtos do Butantan, Paulo Lee Ho, que acompanhou de perto esse processo. Enquanto o Butantan desenvolvia seu processo produtivo, parte das vacinas fornecidas ao Ministério da Saúde eram produzidas no Brasil, e a outra parte na França. O Instituto começou fornecendo 6,3 milhões de doses em 2013; em apenas três anos, a produção aumentou mais de sete vezes, chegando a 46 milhões. Em 2023, o Butantan atingiu a capacidade produtiva necessária para fornecer 100% das doses da campanha – ou seja, 90 milhões de doses. LEIA TAMBÉM: Butantan recebe aprovação da Anvisa para início de testes da vacina contra a gripe aviária “Foi se estabelecendo não só uma estrutura fabril, mas uma estrutura piloto e laboratorial, e isso gerou a incorporação das Boas Práticas de Laboratório, de Fabricação e Clínicas, conforme esses conceitos avançavam internacionalmente”, aponta a coordenadora de Redação Médica do Butantan, Maria da Graça Salomão, que participou dos estudos da Influenza. Como a vacina da Sanofi já havia passado com sucesso por ensaios clínicos de fase 1, 2 e 3, após completar a transferência de tecnologia e assumir sua fabricação, o Butantan conduziu estudos de fase 4, entre 2013 e 2015, por exigência da Anvisa. Os pesquisadores avaliaram a vacina em adultos saudáveis, idosos e pacientes receptores de transplante renal. “Após esse período, houve um entendimento por parte da Anvisa de que não era necessário repetir os ensaios clínicos todo ano enquanto a população já era vacinada, e que a vigilância pós-comercialização era o melhor instrumento de avaliação de segurança das atualizações de cepas”, explica a gerente de Farmacovigilância do Butantan Maria Beatriz Lucchesi. A cada campanha, a vacina é atualizada com as cepas mais circulantes do vírus influenza, de acordo com diretrizes da Organização Mundial da Saúde (OMS). Apesar dessa decisão, os estudos não pararam. Pelo contrário: à medida que se transformava no principal fornecedor da vacina da gripe no Brasil, o Butantan continuou investindo em outras pesquisas para aprimorar o imunizante, chegando a conquistar a pré-qualificação da OMS em 2021 e desenvolver vacinas contra cepas potencialmente pandêmicas. O Instituto também participou do combate à pandemia de H1N1, em 2009. Conheça mais sobre os desdobramentos dos estudos envolvendo a vacina Influenza no Instituto Butantan: Pandemia de H1N1 Em 2009, o mundo enfrentou a pandemia de H1N1, doença que ficou conhecida como gripe suína e atingiu mais de 70 países. De acordo com a OMS, o surto começou com a propagação de um vírus influenza tipo A originado de uma cepa animal e não relacionado aos vírus H1N1 sazonais. No Brasil, o Butantan esteve à frente do combate à doença, produzindo a vacina com a cepa pandêmica – já como parte do processo de transferência tecnológica do imunizante da Sanofi. Em 2010, o PNI adquiriu 83 milhões de doses da vacina. Na época, o Instituto investigou a segurança e a imunogenicidade da vacina H1N1 com diferentes adjuvantes (substâncias usadas para potencializar a resposta imune). Também foram feitos estudos para avaliar o imunizante em públicos vulneráveis, como pacientes com doenças crônicas, imunossuprimidos, idosos e gestantes – grupos que concentravam a maioria das mortes decorrentes da doença. A vacinação ajudou a conter os casos de gripe suína e levou a OMS a decretar o fim da pandemia em agosto de 2010. No período da emergência sanitária, foram confirmados oficialmente 18.500 mortes por H1N1 no mundo, mas um estudo do Centro de Controle e Prevenção de Doenças (CDC) dos Estados Unidos estima que podem ter ocorrido entre 151.700 e 575.400 óbitos. No Brasil, foram registrados quase 60 mil casos e mais de 2 mil mortes. Reconhecimento da OMS Em 2016, o Butantan submeteu um pedido à OMS para a inclusão da vacina Influenza em sua lista de imunizantes pré-qualificados. A organização solicitou um estudo de não inferioridade entre a versão do Butantan e a da Sanofi. Foram anos de trabalho da equipe de Ensaios Clínicos e Farmacovigilância para atender às exigências do órgão e conquistar esse título internacional. A OMS aprovou a pré-qualificação do imunizante em 2021 – uma validação
Anvisa proíbe comercialização de creme dental da Colgate após denúncias de reações adversas

A Agência Nacional de Vigilância Sanitária (Anvisa) determinou a suspensão da comercialização do creme dental Colgate Clean Mint em todo o território nacional. A decisão foi tomada após a agência receber inúmeros relatos de consumidores que apresentaram reações adversas após o uso do produto. A interdição ocorre em março de 2025 e pode ser contestada pela empresa em até 90 dias. Os consumidores afetados relataram sintomas como inchaço nas amígdalas, lábios e mucosa oral, além de ardência, dormência na boca, sensibilidade gengival, aftas e vermelhidão. Entre janeiro e março de 2025, foram registradas oito notificações formais e 13 casos documentados de reações adversas associadas ao novo creme dental. A Colgate alterou a fórmula do produto em julho de 2024, substituindo o fluoreto de sódio pelo fluoreto de estanho, um composto químico conhecido por suas propriedades antimicrobianas. A empresa afirmou que a nova fórmula passou por mais de uma década de pesquisa e testes rigorosos, sendo amplamente utilizada em cremes dentais ao redor do mundo. Em nota, a Colgate defendeu a segurança do fluoreto de estanho, mas reconheceu que uma pequena parcela da população pode apresentar sensibilidade a determinados ingredientes, como corantes ou sabores. A empresa orientou os consumidores que apresentarem reações adversas a interromperem o uso do produto e contatar o canal de atendimento pelo telefone 0800 703 7722. A Anvisa reforça que os consumidores que experimentaram sintomas devem buscar orientação médica e relatar suas experiências para auxiliar nas investigações. Durante o período de interdição, a Colgate terá a oportunidade de apresentar evidências e recorrer da decisão. A situação destaca a importância do monitoramento contínuo da segurança dos produtos de consumo e da comunicação transparente entre fabricantes, reguladores e consumidores. Enquanto isso, os consumidores são aconselhados a buscar alternativas seguras caso apresentem reações adversas.
Anvisa suspende venda e propwdaganda de “chips da beleza”
Desde o ano passado, a prescrição de terapias hormonais para fins estéticos, como ganho de massa muscular e melhora no desempenho esportivo, está proibida por outra resolução, aprovada pelo Conselho Federal de Medicina (CFM).
Anvisa Propõe Novas Advertências para Produtos Derivados do Tabaco

A Agência Nacional de Vigilância Sanitária (Anvisa) divulgou propostas de imagens de advertência sanitária para as embalagens
Proibição de Marcas de Azeite e Coco Ralado no Brasil por Irregularidades da Anvisa

A Agência Nacional de Vigilância Sanitária (Anvisa) proibiu a importação e distribuição de azeites das marcas Serrano e Cordilheira

